一、蛋白质通论
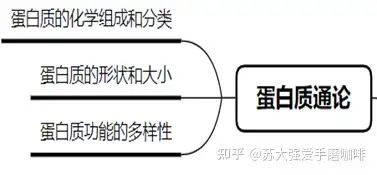
1、蛋白质的化学组成和分类
Ø 蛋白质的元素组成:C、H、O、N、S,其中含N平均为16%,这一数据可用于蛋白质的含量测定。
Ø 分类:简单蛋白:完全由氨基酸组成,不含非蛋白成分。
结合蛋白:由蛋白质和非蛋白成分组成,后者称为辅基。
Ø 按照蛋白质的生物学功能分类:催化功能、结构功能、运输功能、贮存功能、运动功能、防御功能、调节功能、感觉功能、遗传调控功能、其他功能
2、按照蛋白质的形状和溶解度:纤维状蛋白质、球状蛋白质
Ø 纤维状蛋白质:具有比较简单、有规则的线性结构,形状呈细棒或纤维状,大部分不溶于水和稀盐溶液,如 胶原蛋白、弹性蛋白、角蛋白、丝蛋白等。
Ø 球状蛋白质:形状接近球形或者椭球形,球状蛋白质在水中的溶解性好,如胞质酶类。
Ø 膜蛋白:与细胞的各种膜系统结合而存在。膜蛋白不溶于水但能融于去污剂溶液。
3、蛋白质的生物学功能:催化、调节、转运、贮存、运动、结构成分、支架作用、防御和进攻、特殊功能
二、蛋白质一级结构的测定
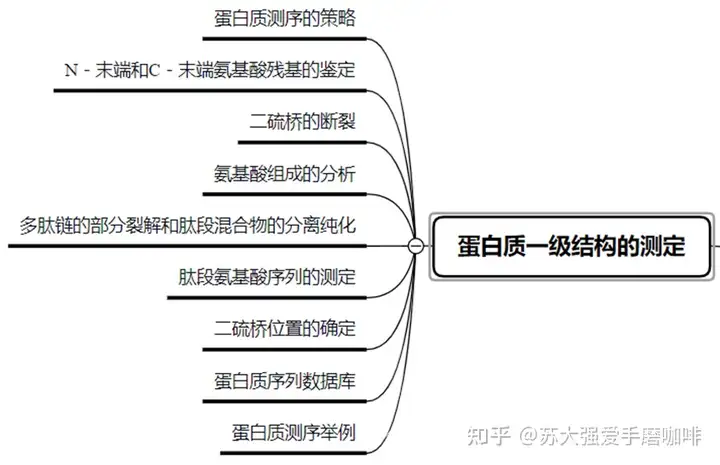
1、蛋白质测序的策略
l 确定蛋白质的纯度在97%以上。
l 测定多肽链的数目。
l 拆分多肽链。
l 析每一条多肽链的氨基酸组成。
l 鉴定多肽链的N—末端和C—末端氨基酸残基。
l 用两种以上方法裂解多肽链成较小的肽段。
l 测定各肽段的氨基酸序列。
l 拼接各肽段成完整的多肽链。
l 确定二硫键的位置。
2、N-末端氨基酸残基的鉴定
l 二硝基氟苯(DNFB)法(Sanger法)
l 丹黄酰氯法
l 异硫氰酸苯酯法(PITC)
l 氨肽酶法
3、C-末端氨基酸残基的鉴定
l 还原法
l 肼解法
l 羧肽酶法
4、二硫键断裂及位置确定
l 断裂:氧化剂和还原剂都可打开二硫键。过甲酸可以定量地打开二硫键,生成磺基丙氨酸残基。
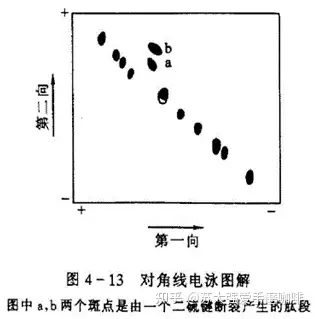
l 确定:用对角线电泳法:电泳,过甲酸熏蒸断裂二硫键,二向电泳
5、多肽链的部分裂解和肽段混合物的分离纯化
l 酶法裂解
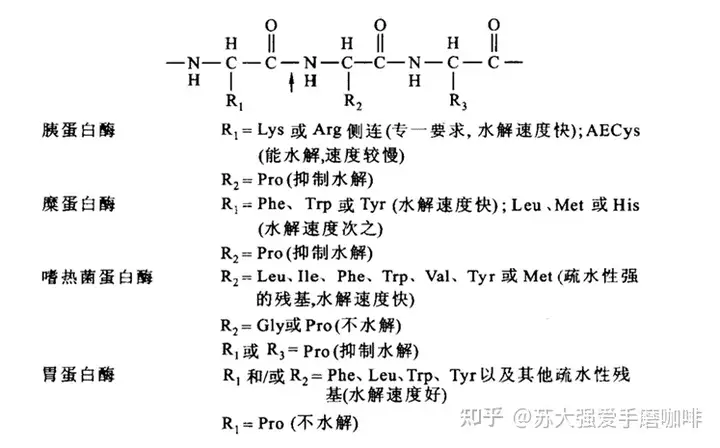
l 化学法裂解
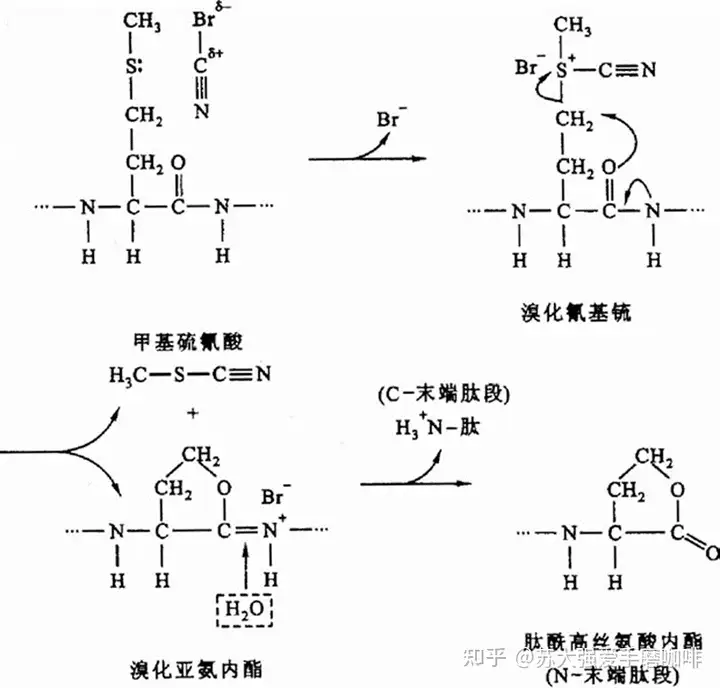
6、氨基酸序列测定
l Edamn化学法降解法
l 降解法
l 根据核苷酸序列推定法
l 质谱法
三、蛋白质的空间结构
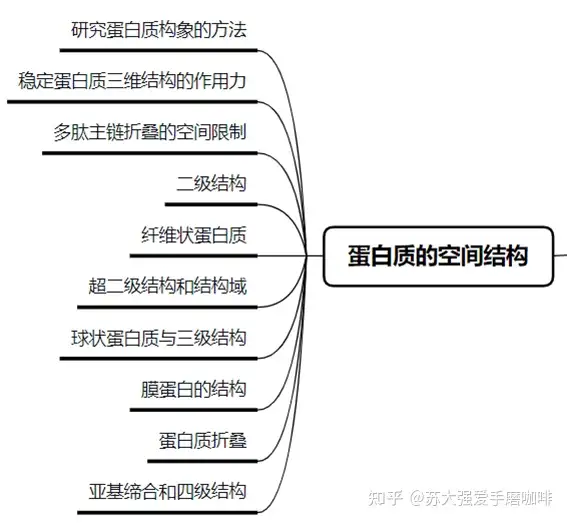
1、研究蛋白质构象的方法:X射线衍射法(获得电子密度图),紫外差光谱(检测共轭基团在不同微环境中的吸收变化,推测其空间位置和蛋白构象),荧光和荧光偏振,圆二色性(蛋白质上的手性分子与偏振光的作用推测其构象),核磁共振(NMR)
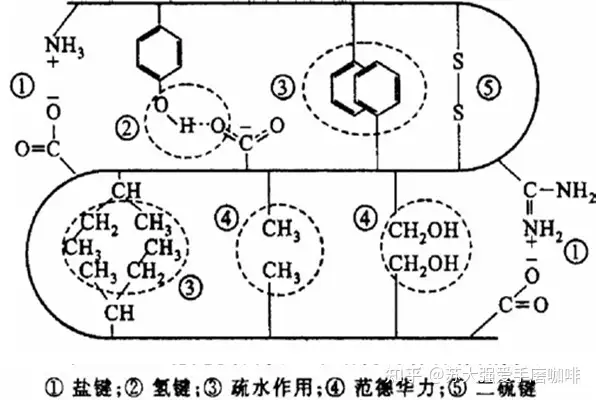
2、稳定蛋白质三维结构的作用力
3、二级结构
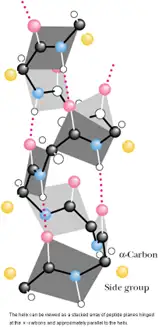
Ø α螺旋:多肽链中的各个肽平面围绕同一轴旋转,形成螺旋结构,螺旋一周,沿轴上升的距离即螺距为0.54nm,含3.6个氨基酸残基;两个氨基酸之间的距离为0.15nm。
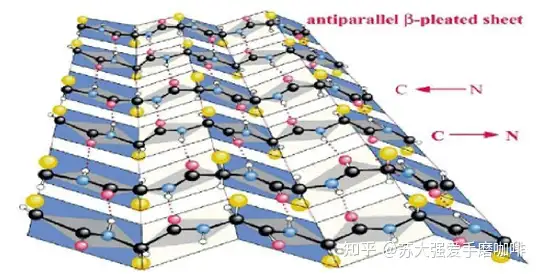
Ø β折叠:是由两条或多条几乎完全伸展的肽链平行排列,通过链间的氢键交联而形成的。
Ø β转角和β凸起:
l β-转角由四个氨基酸残基组成,弯曲处的第一个氨基酸残基的-C=O和第四个残基的N-H之间形成氢键,形成一个不很稳定的环状结构。多位于分子表面,促进肽链回折。
l β凸起可以认为是β折叠中额外插入一个氨基酸残基,使得两个正常氢键之间一侧是两个氨基酸残基,一侧是一个氨基酸残基。
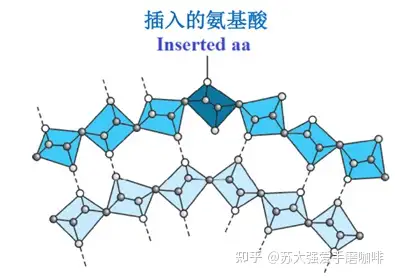
β凸起
Ø 无规卷曲:指多肽链主链既非螺旋、又非折叠片或转角的,没有一定规律的松散结构。
4、超二级结构和结构域
Ø 超二级结构:蛋白质二级结构和三级结构之间的一个过渡性结构层次,在肽链折叠过程中,因一些二级结构的构象单元彼此相互作用组合而成。
Ø 结构域:生物大分子中具有特异结构和独立功能的区域,在二级结构、超二级结构基础上形成的三级结构局部折叠区,相对独立的紧密结构实体,称为结构域,往往与功能相关,也称作功能域。
5、亚基缔合和四级结构
Ø 概念:特指组成蛋白质的各个亚基通过非共价键相互作用(包括疏水相互作用、氢键和盐键等)排列组装而成的立体结构。
驱动力:范氏作用力,氢键,离子键,疏水作用力和二硫键。












